ปฏิกิริยาของสารประกอบอินทรีย์ (Organic Reactions)
ประเภท
1.ปฏิกิริยาการแทนที่ Substitution reactions เกิดเฉพาะสารประกอบคาร์บอนที่อิ่มตัวแล้ว
2.ปฏิกิริยาการเติม Addition reaction เกิดเฉพาะสารประกอบคาร์บอนที่ไม่อิ่มตัว
3.ปฏิกิริยาการขจัดออก Elimination reaction
4.ปฏิกิริยาการจัดเรียงตัวใหม่ Rearrangement reaction
5. Polymerization ทำให้สารประกอบคาร์บอนมีโมเลกุลใหญ่ขึ้นโดยมีหมู่ซ้ำกัน
6.ปฏิกิริยาการแตกตัว (Cracking Reaction)
การสร้างและการทำลายพันธะ
1.การสร้างพันธะ
แบบที่ 1สร้างพันธะแบบเสมอภาค(Homolytic Forming) การสร้างพันธะระหว่างอะตอมของธาตุ 2 อะตอม โดยใช้ e- อะตอมละ 1 e-ร่วมกันเกิด Covalent Bond 1 พันธะ
แบบที่ 2 สร้างพันธะแบบไม่เสมอภาค(Heterolytic Forming) การสร้างพันธะโดยอะตอมหนึ่งเป็นอะตอมให้ 2 e กับอีก atom หนึ่ง เกิด Covalent Bond 1 พันธะ
2.การทำลายหรือการแตกพันธะ
แบบที่ 1 Homolytic Cleavage การแตกแบบเสมอภาค :แบ่ง e- ไปอะตอมละ 1 ได้อนุมูลอิสระ (Free Radical) - ปฏิกิริยา Free Radical
แบบที่ 2 Heterolytic Cleavage การแตกแบบไม่เสมอภาค อะตอมที่ใช้ e- ร่วมกันอะตอมหนึ่งดึง e- ไปทั้งคู่ ได้เป็น อนุมูลประจุบวก (Cation) และอนุมูลประจุลบ (Anion) ขึ้นอยู่กับค่า EN ของธาตุที่สร้างพันธะร่วมกัน – ปฏิกิริยา ionic
สารมัธยันตร์ที่พบในเคมีอินทรีย์ (Intermediate)
สารมัธยันตร์ที่พบในเคมีอินทรีย์ จำแนกเป็น 4 แบบ คือ Carbon Radical, Carbocation or Carbonium ion, Carboanion or Carbanion และ Carbene
ความเสถียรของ Carbon Radical
Carbon Radical เป็นสารที่ขาด e- เพราะมี valence e- 7 ตัว หมู่ Alkyl (R) เป็นหมู่ที่ให้ e- ได้ดีกว่า H ดังนั้นยิ่งมีหมู่ Alkyl มากขึ้นก็ยิ่งเสถียรมากขึ้น ลำดับความเสถียรดังนี้ 3o>2o>1o> methyl radical
ความเสถียรของ Carbocation
Carbocation เป็นสารที่ขาด e- เพราะมี valence e- 6 ตัว หมู่ Alkyl (R) เป็นหมู่ที่ให้ e- ได้ดีกว่า H ดังนั้นยิ่งมีหมู่ Alkyl มากขึ้นก็ยิ่งเสถียรมากขึ้น ลำดับความเสถียรดังนี้ 3o>2o>1o> methyl carbocation
ความเสถียรของ Carboanion
Carboanion มี 8 valence e- หมู่ Alkyl (R) เป็นหมู่ที่ให้ e- ได้ดีกว่า H ดังนั้นยิ่งมีหมู่ Alkyl มากขึ้น ความเสถียรจะน้อยลง ลำดับความเสถียรดังนี้ 3o>2o>1o> methyl radical
ผลที่เกิดขึ้น (จากการเหนี่ยวนำ)
หมู่ที่มีผลทางการเหนี่ยวนำ แบ่งเป็น 2 ประเภท
1.หมู่ที่ให้ Electron (Electron donating group) ได้แก่
Alkyl,
หมู่ที่มี Oxygen, หรือ Nitrogen ที่เป็นประจุลบ
2.หมู่ที่ดึง Electron (Electron withdrawing group) ได้แก่
หมู่ Halogen (-X)
หมู่อะมิโน (-NH2)
หมู่ไฮดรอกซิล –(OH)
หมู่ Carbonyl
หมู่ Nitro (-NO2)
หมู่แอมโมเนียม –NH3
หมู่ฟีนิล
ผลของการเหนี่ยวนำที่มีอิทธิพลต่อปัจจัยต่างๆของสารอินทรีย์
1เกิดความเป็นขั้ว เช่น Ethane, Fluoroethane
2ความว่องไวขึ้นอยู่กับสารตั้งต้น
3พิจารณาความเสถียร หมู่ไหนที่อะตอมกลางขาด e- แล้วมีหมู่อะตอมมาให้ e- จะทำให้เสถียรมากขึ้น หมู่ไหนที่อะตอมกลาง e- แล้วมีหมู่อะตอมมาดึง e- จะทำให้เสถียรต่ำลง
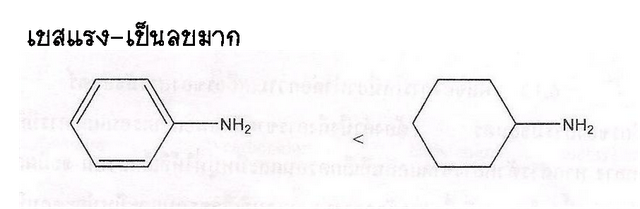
4. ผลของการเหนี่ยวนำต่อความเป็นกรด เบสของสาร หมู่ไหนที่แสดงสมบัติเป็นบวกมากๆ จะสามารถแตกตัวให้ H+ (กรด)ได้ดี ถ้าหมู่ไหนที่แสดงสมบัติเป็นลบมากๆ ก็จะเป็นเบสมากกว่า
การเกิด Resonance Effect
การเกิด Resonance คือการที่ π- e- หรือ electron คู่โดดเดี่ยวเคลื่อนที่ผ่านพันธะไพ การเคลื่อนที่ของอิเล็กตรอน เรียกว่า Delocalisation